บทที่ 15 ความร้อนและแก๊ส
เมื่อกล่าวถึงความร้อนเรามักจะนึกถึงความร้อนที่พบในชีวิตประจำวัน ได้แก่ ความร้อนจากดวงอาทิตย์และความร้อนจากการเผาไหม้ มนุษย์ได้ใช้ประโยชน์จากความร้อนดังกล่าว ในการดำรงชีวิตมากมาย เช่นการหุงต้มอาหาร การให้ความอบอุ่นในวันที่อากาศหนาวเย็น การเผาไหม้เพื่อทำให้เครื่องยนต์และเครื่องจักรทำงาน
การศึกษากระบวนการเปลี่ยนแปลงระหว่างความร้อนและพลังงานกล เป็นสาขาหนึ่งในวิชาฟิสิกส์ เรียกว่าอุณหพลศาสตร์ ซึ่งในบทนี้ จะศึกษาอุณหพลศาสตร์ ในขอบเขตที่ครอบคลุม ระบบที่เป็นแก๊สของแข็งและของเหลว โดยเน้นที่การอธิบายความร้อนจากพฤติกรรมของแก๊ส
อุปกรณ์ที่ใช้วัดอุณหภูมิ เรียกว่าเทอร์โมมิเตอร์ เทอร์โมมิเตอร์มีหลายชนิด ส่วนใหญ่ทำงานโดยอาศัยสมบัติของสารที่เปลี่ยนแปลงตามอุณหภูมิ เส้นปริมาตร ความต้านทานไฟฟ้า และสีเป็นต้น
อุณหภูมิในเคลวิน เรียกว่า อุณหภูมิสัมบูรณ์ และที่อุณหภูมิ 0 เคลวิน เรียกว่าศูนย์สัมบูรณ์ อุณหภูมิดังกล่าวถือเป็นอุณหภูมิต่ำที่สุดในทางทฤษฎี ที่เป็นไปได้ของสสาร ซึ่งเป็นอุณหภูมิที่อนุภาคหยุดการเคลื่อนไหวอย่างสิ้นเชิง
ความรู้เพิ่มเติม
นอกจากอุณหภูมิในเคลวิน มีชื่อเรียกว่า อุณหภูมิสัมบูรณ์แล้ว ยังมีชื่อเรียกว่า อุณหภูมิอุณหพลวัตอีกด้วย
ถ้าให้ T เป็นอุณหภูมิในหน่วยเคลวิน (K) และ t เป็นอุณหภูมิในหน่วยองศาเซลเซียส อุณหภูมิทั้งสองมีความสำคัญดังนี้
ความจุความร้อนและความร้อนจำเพาะ
ความจุความร้อน (C) คือปริมาณความร้อน ΔQ จูล ที่ทำให้มวลสารมวล m กิโลกรัม
มีอุณหภูมิเปลี่ยนไป 1 เคลวิน มีหน่วยเป็นจูล/เคลวิน
.jpg)
ความจุความร้อนจำเพาะ (c) คือปริมาณความร้อน ΔQ จูล ที่ทำให้มวลสารมวล 1 กิโลกรัม
มีอุณหภูมิเปลี่ยนไป 1 เคลวิน มีหน่วยเป็นจูล/กิโลกรัม.เคลวิน
.jpg)
เมื่อ c คือ ความจุความร้อนจำเพาะของสาร
ΔQ คือ ปริมาณความร้อนที่มวลสารได้รับ
Δt คือ อุณหภูมิของมวลสารที่เปลี่ยนไป
m คือ ปริมาณมวลสาร
.jpg)
ความร้อนแฝง
.png)
ความร้อน ที่ใช้ในการเปลี่ยนสถานะ ของสารมวล 1 หน่วย โดยอุณหภูมิไม่เปลี่ยน เรียกว่า ความร้อนแฝง ซึ่งจะมีความสัมพันธ์กับความร้อนที่ให้กับสารดังสมการ
.jpg)
การถ่ายโอนความร้อนและสมดุลความร้อน
ความร้อนสามารถถ่ายโอนหรือส่งผ่านจากวัตถุที่มีอุณหภูมิสูงกว่าไปสู่ วัตถุที่มีอุณหภูมิต่ำกว่าได้ เราสามารถอธิบายกระบวนการถ่ายโอนความร้อนได้ดังนี้
การนำความร้อน เป็นการถ่ายโอนความร้อนผ่านตัวนำความร้อนโดยที่โมเลกุลแต่ละโมเลกุลของตัวนำไม่ได้เคลื่อนที่ตามไปด้วย
การพาความร้อน เป็นการถ่ายโอนความร้อนโดยอาศัยการเคลื่อนที่ของโมเลกุลของสสารพาความร้อนจากที่หนึ่งไปยังอีกที่หนึ่ง
การแผ่รังสีความร้อน เป็นการถ่ายโอนความร้อนโดยไม่ต้องอาศัยตัวกลาง การถ่ายโอนความร้อนเกิดขึ้นเมื่อวัตถุ 2 อันที่สามารถถ่ายโอนความร้อนถึงกันและกันได้มีอุณหภูมิแตกต่างกัน
แก๊สอุดมคติ
สำหรับสารในสถานะแก๊ส โมเลกุลของแก๊สสามารถเคลื่อนที่ได้อย่างอิสระและฟุ้งกระจายเต็มภาชนะที่บรรจุ ถ้าเปลี่ยนปริมาตรของภาชนะที่ใช้ในการบรรจุแก๊ส แก๊สก็จะมีปริมาตรเปลี่ยนไป ตามปริมาตรของภาชนะที่บรรจุ
แก๊สอุดมคติ คือแก๊สที่มีสมบัติดังต่อไปนี้
- มีโมเลกุลขนาดเล็กมาก จนถือได้ว่าเป็นปริมาตรแต่ละโมเลกุลน้อยจนเกือบเป็นศูนย์เมื่อเทียบกับปริมาตรของภาชนะที่บรรจุ
- ไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุล แต่จะมีแรงกระทำต่อโมเลกุลของแก๊ส เมื่อมีการชนกันเองหรือชนกับผนังภาชนะ
- มีการเคลื่อนที่แบบสุ่ม กล่าวคือการเคลื่อนที่ของโมเลกุลของแก๊สมีขนาดและทิศทางของความเร็วไม่แน่นอน โดยทุกโมเลกุลของแก๊สจะมีโอกาสในการเคลื่อนที่ด้วยความเร็วขณะใดๆ และทิศทางใดๆด้วย ความน่าจะเป็นที่เท่ากันทุกโมเลกุล
- .ความน่าจะเป็นที่โมเลกุลของแก๊สจะมีความเร็วค่าใดค่าหนึ่งและทิศทางใดทิศทางหนึ่งมีค่าเท่ากัน
- มีการชนแบบยืดหยุ่นกล่าวคือโมเลกุลของแก๊สจะไม่มีการสูญเสียพลังงานจลน์ระหว่างการชน ไม่ว่าจะเป็นการชนกันระหว่างโมเลกุลของแก๊ส หรือการชนกับผนังภาชนะ
.jpg)
.jpg)
Credit : @pewwhip
.jpg)
.jpg)
ทฤษฎีจลน์ของแก๊ส
.gif)
เป็นทฤษฎีที่ตั้งขึ้นเพื่อใช้อธิบายกฎ ปรากฏการณ์ หรือผลการทดลองที่เกี่ยวกับแก๊ส และพฤติกรรมของแก๊ส
- แก๊สประกอบด้วยอนุภาคจำนวนมากที่มีขนาดเล็กมาก จนถือได้ว่าอนุภาคของแก๊สไม่มีปริมาตรเมื่อเทียบกับขนาดภาชนะที่บรรจุ โมเลกุลของแก๊สอยู่ห่างกันมาก ทำให้แรงดึงดูดและแรงผลักระหว่างโมเลกุลน้อยมาก จนถือได้ว่าไม่มีแรงกระทำต่อกัน
- โมเลกุลของแก๊สเคลื่อนที่อย่างรวดเร็วในแนวเส้นตรง เป็นอิสระ ด้วยอัตราเร็วคงที่ และไม่เป็นระเบียบ จนกระทั่งชนกับโมเลกุลอื่น ๆ หรือชนกับผนังภาชนะจึงจะเปลี่ยนทิศทางและอัตราเร็ว
- โมเลกุลของแก๊สที่ชนกันเองหรือชนกับผนังภาชนะจะเกิดการถ่ายโอนพลังงานให้แก่กันได้ แต่พลังงานรวมของระบบคงที่ ณ อุณหภูมิเดียวกัน โมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่ด้วยอัตราเร็วไม่เท่ากัน แต่จะมีพลังงานจลน์เฉลี่ยเท่ากัน โดยที่
- พลังงานจลน์เฉลี่ยของแก๊สจะแปรผันตรงกับอุณหภูมิเคลวิน
+ แก๊สที่มีสมบัติเป็นไปตามทฤษฎีจลน์ของแก๊สทุกประการเรียกว่า แก๊สอุดมคติ (Ideal gas) โดยปกติแก๊สทั่วไปจะมีสมบัติเคียงกับแก๊สอุดมคติเท่านั้น
สำหรับแก๊สที่มีอนุภาคขนาดเล็ก เมื่อควบคุมให้อยู่ในภาวะที่มีปริมาตรมาก ความดันต่ำ และอุณหภูมิสูง จะมีสมบัติใกล้เคียงกับแก๊สอุดมคติมากขึ้น
โดยเฉพาะแก๊สเฉื่อยจะมีสมบัติใกล้เคียงกับแก๊สอุดมคติมากจนอาจจัดเป็นแก๊สอุดมคติได้
.jpg)
กฎข้อที่ 1 ของอุณหพลศาสตร
พลังงานภายในระบบ
พลังงานภายในระบบ คือ ผลรวมของพลังงานจลน์เฉลี่ยทั้งหมดของแก๊สในระบบปิด เขียนแทนด้วยสัญญลักษณ์
“ U ”
การเปลี่ยนแปลงพลังงานภายในระบบ คือ ผลต่างของพลังงานภายในระบบหลังเปลี่ยนแปลง กับพลังงานภายในระบบก่อน เปลี่ยนแปลง เขียนแทนด้วย “U”
ระบบประกอบด้วยสิ่งต่างๆ ที่อยู่ในขอบเขตที่ต้องการศึกษา เช่น ระบบโมเลกุลของแก๊สจะประกอบด้วยโมเลกุลของแก๊สทุกตัวในภาชนะ พลังงานภายในของระบบคือ พลังงานทั้งหมดของโมเลกุลของแก๊สในระบบ
เทอร์โมไดนามิกส์ (Thermo Dynamics)
คือ การศึกษาที่เกี่ยวกับการถ่ายโอนพลังงานความร้อนและงานที่ระบบกระทำหรือถูกกระทำโดยสิ่งแวดล้อม
กฎข้อที่ศูนย์ของเทอร์โมไดนามิกส์
ถ้าวัตถุ A และวัตถุ B อยู่ในสมดุลทางความร้อน และวัตถุ A กับวัตถุ C อยู่ในสมดุลทาง
ความร้อนแล้ว วัตถุ B กับวัตถุ C ก็จะอยู่ในสภาวะสมดุลทางความร้อนด้วย กล่าวคือ มีอุณหภูมิเท่ากัน
กฎข้อที่ 1 ของเทอร์โมไดนามิกส์ (กฎอนุรักษ์พลังงาน)
ความร้อนที่ระบบได้รับเท่ากับพลังงานภายในของระบบที่เพิ่มขึ้นบวกกับงานที่ระบบได้รับจาก สิ่งแวดล้อม
- ระบบเปิด คือ ระบบที่สามารถเกิดการถ่ายเทมวลสาร เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้
- ระบบปิด คือ ระบบที่ไม่สามารถเกิดการถ่ายเทมวลสาร เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้ แต่อาจจะเกิดการถ่ายเทพลังงานได้
- ระบบโดดเดี่ยว คือ ระบบที่ไม่สามารถเกิดการถ่ายเทมวลสารและพลังงาน เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้
.gif)
การประยุกต์ของอุณหภูมิพลศาสตร์
.jpg)
หา'การเปลี่ยนแปลงอุณหภูมิ'กัน
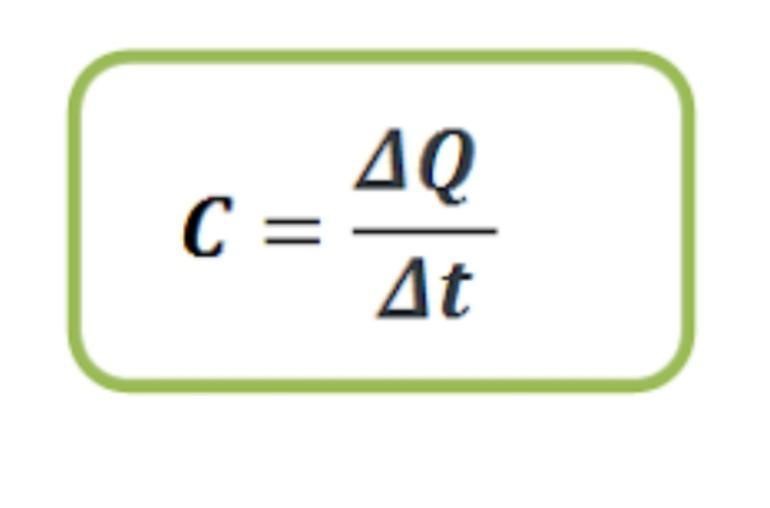
ความจุความร้อนจำเพาะของสาร(c)
ปริมาณความร้อนที่มวลสารได้รับ(ΔQ) จูล(J)
อุณหภูมิของมวลสารที่เปลี่ยนไป(Δt) เคลวินหรือเซลเซียน
———————————
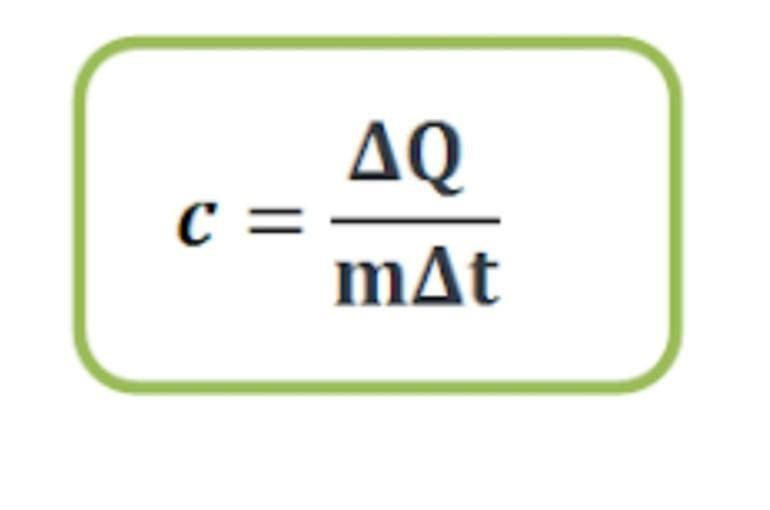
ความจุความร้อนจำเพาะของสาร(c)
ปริมาณความร้อนที่มวลสารได้รับ(ΔQ) แคลอรี หรือ จูล(J)
อุณหภูมิของมวลสารที่เปลี่ยนไป(Δt) เคลวินหรือเซลเซียน
ปริมาณมวลสาร(m) กิโลกรัม(kg) หรือ กรัม (g)
———————————
หา'การเปลี่ยนสถานะ'กัน
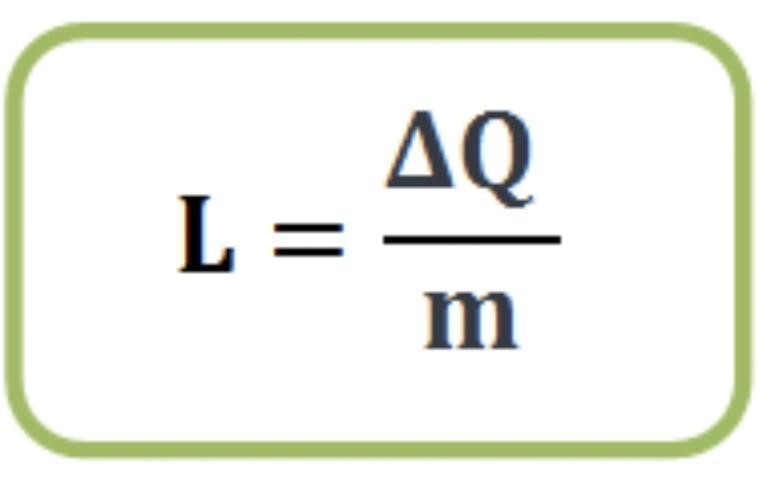
ความร้อนแฝงจำเพาะ(L) แคลอรี/กรัม
ปริมาณความร้อน(ΔQ) แคลอรี หรือ จูล(J)
มวล(m) กิโลกรัม(kg) หรือ กรัม (g)
———————————
หา'งานของระบบ'กัน
W = PΔV
งาน(W) จูล(J)ความดัน(P) ปาสคาล(Pa)
การเปลี่ยนแปลงปริมาตร(ΔV) ลิตร(L)
———————————
หา'แก๊สในอุดมคติ'กัน
PV = nRT
ความดันของแก๊ส(P) (atm)ปริมาตรของแก๊ส(V) (Litre หรือ L , dm3)
จำนวนโมลของแก๊ส(n) (mol)
อุณหภูมิในหน่วยเคลวิน(T) (K)
———————————
แบบทดสอบเรื่อง ความร้อนและแก๊ส
| Quizizz | rmutphysics | kruseksan | physics |
|---|
แหล่งที่มา
https://sites.google.com/http://www.rmutphysics.com/
แหล่งที่มา แบบทดสอบ
https://quizizz.com/http://www.rmutphysics.com/
http://www.kruseksan.com/
http://physics.ipst.ac.th/